CNR: identificate le super-cellule per rigenerare il cuore. Uno studio pubblicato su Cell Death and Differentiation.
 Uno studio condotto in collaborazione tra il CNR e l’IRCCS MultiMedica ha identificato le staminali multipotenti indotte per la rigenerazione dei cardiomiociti. La ricerca è stata pubblicata sulla rivista Cell Death and Differentiation.
Uno studio condotto in collaborazione tra il CNR e l’IRCCS MultiMedica ha identificato le staminali multipotenti indotte per la rigenerazione dei cardiomiociti. La ricerca è stata pubblicata sulla rivista Cell Death and Differentiation. Uno studio in collaborazione tra l’Istituto di biologia cellulare e neurobiologia del Consiglio Nazionale delle Ricerche (Ibcn-Cnr) di Roma e l’Istituto di ricovero e cura a carattere scientifico MultiMedica di Milano apre nuove prospettive nel panorama delle terapie cellulari, dimostrando per la prima volta che i cardiomiociti – le cellule del cuore - possono essere una fonte di cellule staminali con caratteristiche "differenziative" vantaggiose rispetto ad altre staminali. La ricerca, condotta dai ricercatori Roberto Rizzi e Claudia Bearzi, è stata pubblicata sulla rivista Cell Death and Differentiation. «I cardiomiociti - spiega Roberto Rizzi - hanno capacità proliferative minime se non assenti e ciò significa che a seguito di danno ischemico cardiaco, come per esempio nell’infarto, si crea una cicatrice riducendo la capacità funzionale del cuore, situazione nota come scompenso cardiaco. Il nostro lavoro ha dimostrato che, attraverso l’introduzione di geni fetali all’interno del genoma di cardiomiociti post-natali, è possibile ricondurre queste cellule già differenziate a uno stato embrionale. Una volta ottenute le staminali dai cardiomiciti, queste sono state indotte a differenziare nuovamente in cellule cardiache battenti. La ricerca ha messo in evidenza che le cellule multipotenti indotte ottenute dai cardiomiociti hanno una capacità maggiore di ridiventare nuovamente cellule cardiache contrattili, rispetto ad altre cellule staminali, e ne ha definito le basi molecolari stabilendo che questa ‘memoria’ dipende da pochi geni.»
Questa ricerca apre la possibilità di utilizzare i cardiomiociti come cellule staminali cardiache, passando per lo stadio embrionale.
«Grazie alle loro capacità differenziative, queste cellule - commenta Claudia Bearzi - potranno essere utilizzate per la riparazione del miocardio danneggiato. La prerogativa di generare qualsiasi tipo di tessuto è esclusiva delle cellule staminali embrionali ma è noto che restrizioni etiche limitano l’utilizzo delle stesse. Nel 2006, un ricercatore giapponese, Shinya Yamanaka, ha dimostrato la possibilità di riportare cellule neonatali e adulte, quindi già differenziate, ad una condizione di ‘staminalità’, con la capacità di generare tessuti pari a quella delle cellule staminali embrionali con l’introduzione di pochi geni fetali. Queste staminali ottenute da cellule mature erano state definite multipotenti indotte.»
Gli autori della ricerca sono rientrati in Italia dopo un lungo periodo lavorativo negli USA, alla Harvard Medical School. La ricerca è stata finanziata dal ministero della Salute nell’ambito del programma "giovani ricercatori" e viene sostenuta da collaborazioni con altre istituzioni italiane, tra cui le Università di Torino, di Milano Bicocca e Vita e Salute San Raffaele di Milano.
CNR, Roma, 7 febbraio 2012
Post-natal cardiomyocytes can generate iPS cells with an enhanced capacity toward cardiomyogenic re-differentation Open (Cell Death and Differentiation advance online publication 20 January 2012)
Abstract
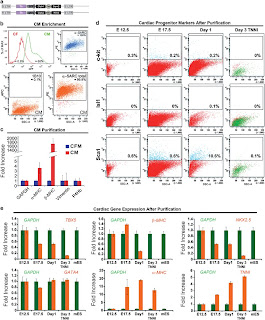
Adult mammalian cells can be reprogrammed to a pluripotent state by forcing the expression of a few embryonic transcription factors. The resulting induced pluripotent stem (iPS) cells can differentiate into cells of all three germ layers. It is well known that post-natal cardiomyocytes (CMs) lack the capacity to proliferate. Here, we report that neonatal CMs can be reprogrammed to generate iPS cells that express embryonic-specific markers and feature gene-expression profiles similar to those of mouse embryonic stem (mES) cell and cardiac fibroblast (CF)-derived iPS cell populations. CM-derived iPS cells are able to generate chimeric mice and, moreover, re-differentiate toward CMs more efficiently then either CF-derived iPS cells or mES cells. The increased differentiation capacity is possibly related to CM-derived iPS cells retaining an epigenetic memory of the phenotype of their founder cell. CM-derived iPS cells may thus lead to new information on differentiation processes underlying cardiac differentiation and proliferation.



Commenti